テロメラーゼとは こちらを編集して記載
染色体末端を保護するテロメアは細胞分裂のたびに短縮し,究極的に短くなると細胞は老化して分裂停止もしくは死滅する.このテロメアを延長する酵素がテロメラーゼで,ヒトでは,無限増殖が可能な胚細胞(生殖系列細胞)と不死化がん細胞では発現しているが,正常体細胞では発現していない(分化した細胞),もしくは発現していても活性が不十分である(幹細胞など)ため分裂寿命は有限となる.ゆえに,ヒトテロメラーゼ研究は当初がん領域で注目されたが,次第に非がん疾患にも重要であることが判明した。2009年、ノーベル生理学・医学賞はテロメラーゼ発見者に授与された.
私たちの細胞は「私たちが持つDNA複製機械はDNA鎖の一番端までコピーすることはできない」という難しい問題と向き合わなくてはならない。
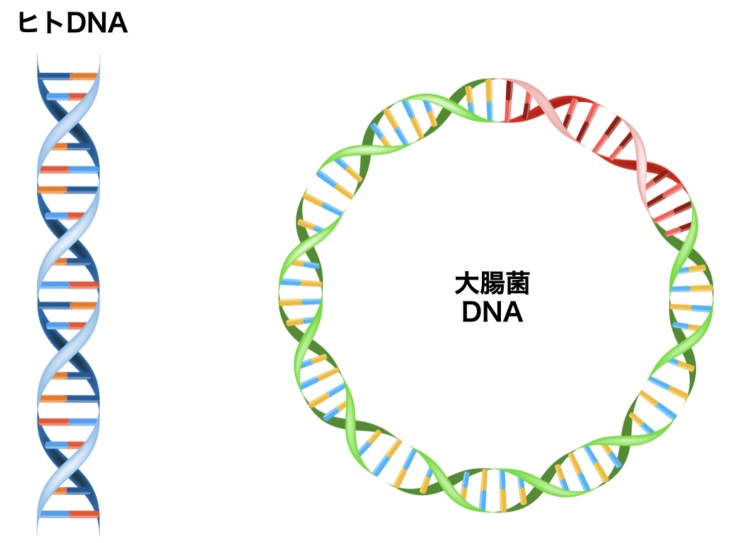
細菌の場合、「染色体を環状にしてこの問題を起こす末端そのものをなくす」という簡単な方法で解決している。(*細菌の環状DNA)
一方、複雑な真核生物の細胞は、遺伝情報を直鎖状のDNA鎖に保持している。恐らく減数分裂のときに遺伝子の組み換えをしやすくするためだと考えられている。そこで細胞分裂の度に染色体が短くならないようにするための特別なしくみが必要になる。
末端を守る
私たちの染色体の末端はテロメア(telomere)と呼ばれるDNAとタンパク質でできた独特な構造で保護されている。テロメアのDNAは TTAGGG の短い配列が約1,000回繰り返されたものが含まれている。この繰り返し区間のほとんどは相補的なDNA鎖と組みになって通常の二重らせんをつくっているが、末端にある数百個のヌクレオチドは一本鎖になっている。この部分は折り返して輪になり、二重鎖領域と相互作用すると考えられている。
6塩基の追加を繰り返す
繰り返しのあるテロメアには短くなった末端を修復できる。テロメアが短くなり過ぎると、細胞はテロメラーゼ(telomerase)を使って新たな繰り返しをつくる。テロメラーゼ酵素は逆転写酵素(TERT)で、RNA鋳型を使いテロメアDNAをつくり出す。その他のタンパク質はこの過程を助ける働きをしていて、必要なときにテロメラーゼをテロメアへと運び、多くの繰り返し配列を連続して追加できるようにテロメアDNAを固定する。
テロメラーゼとがん
テロメラーゼは胎児が発達する間、細胞分裂が何度も行われて完全な体をつくるときに最も活発に働く。その後、ほとんどの細胞での活性はずっと下がり、テロメアは加齢とともにだんだん短くなっていく。しかしテロメラーゼが正しく制御されないと深刻な問題を起こすことがある。がん細胞はテロメラーゼの産生を増やす変異を持っていることが多い。こうするとテロメアを維持し、速やかに細胞分裂を行って腫瘍をつくることができる。
細菌のゲノムの基本構造 こちら
*細菌の環状DNA. 太田敏子. 総説 病原細菌のゲノム生物学:病原微生物の生存戦略. 生化学. 2007. 生化学 79(11),pp. 1032-1045.
細菌のゲノムは多くの場合,1個の環状二本鎖 DNA であり,その長さは80~800万塩基対である.ゲノム上にコードされる遺伝子の数も700~7,900個と菌種によって幅がある.
TERT (telomerase reverse transcriptase)遺伝子とがん JCGA こちら
TERTはテロメラーゼサブユニットの逆転写酵素であり、テロメアの長さとゲノムの安定性の維持に働く。正常な体細胞では発現は極めて低い、または発現していない。一方で、様々ながん種においてTERTの発現の亢進が起きており、この変化ががん細胞の不死化に関与していると考えられている。発現の亢進に関与するのは、プロモーター領域の変異であり、開始コドンより124および146塩基上流に集中して検出される。これら変異により、ETS転写制御因子の結合領域が新たに形成されるためTERTの発現亢進が引き起こされる
村岡 優. 遺伝子検査から肝発がんリスクを診断する. 内科. 2019. 123(5). pp. 1159-1162 こちら
hTERT(human telomerase reverse transcriptase)は,テロメア DNA を合成付加するテロメラーゼの構成蛋白であり,RNA 成分のhTERC(human telomerase RNA component)を鋳型として DNA を合成する.
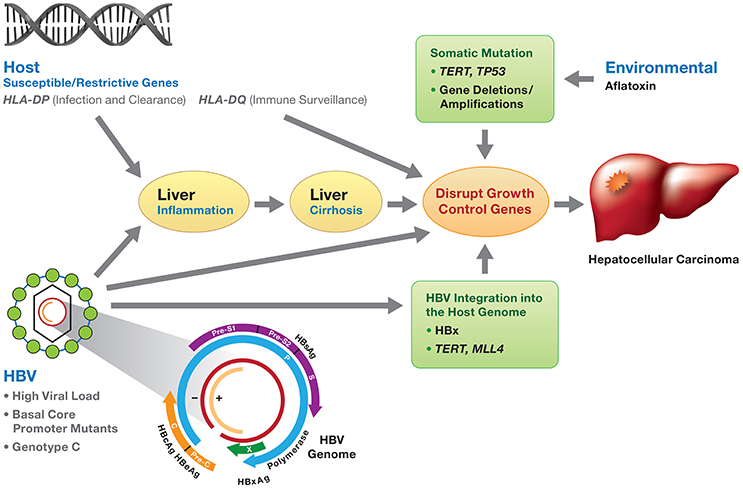
また,TERTはWnt シグナル伝達分子のβカテニンに結合し,βカテニン/TCF 複合体の転写活性を増加させ,細胞老化の防止,生体組織の再生を可能にしている.テロメラーゼ再活性化は悪性転換に重要であり,がんの 90%で活性がみられるとされている.テロメラーゼ再活性化の機序は相互に排他的であり,TERT promoter 変異(約 60%),TERT 増幅(約 5%),および TERT promoterへの HBV 挿入(約 15%)が含まれる.TERT異常と CTNNB1 変異が関連しており,とくにC 型肝炎で両遺伝子変異の頻度が高い.
中川 英刀. 肝臓がんの全ゲノム解読と Precision Medicine への展開. 肝臓. 2017. 58 (10).pp. 551-558 こちら
DNA ウイルスである B 型肝炎ウイルス(HBV)のゲノム(約 3 千塩基)が,宿主である感染肝細胞や肝がん細胞のゲノムに挿入されていることは,30 年以上前より報告されている.
HBV は,感染の比較的初期の段階で,そのゲノムが肝細胞のゲノムに組み込まれ発がんに関わるものと考えられてきた.HBV 陽性の肝がんの全ゲノムシークエンス解析を行うと,HBV の配列が多数検出され,同時にヒトのゲノムと HBV の配列とのキメラ配列も発見される.この情報を利用することにより,HBV ゲノムのヒトゲノムへの挿入部位を同定することができ,10-20% の HBV 関連肝がんで TERT 遺伝子周辺に HBV ゲノム配列がヒトゲノムに integration(組み込み)されていることが判明した.HBV 感染の初期の時期に,HBV ゲノムの挿入が個々の肝細胞にランダムに起こり,その中でTERT遺伝子への挿入など,細胞の生存や増殖に優位性をもった変異を有する肝細胞が,選択的にがん化・進化していったものと推測される.
下図は、HBV関連肝細胞癌におけるTERTの発現について こちら
Ping An. Host and Viral Genetic Variation in HBV-Related Hepatocellular Carcinoma. Front Genet. 2018 19;9:261. doi: 10.3389/fgene.2018.00261. eCollection. PMID: 30073017
写真は横須賀くりはま花の国 HP



コメント